Природа реакции
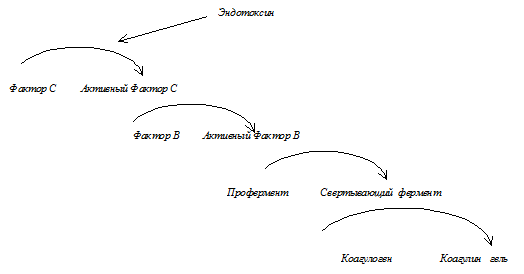
По современным представлениям в лизате амебоцитов находятся, как минимум, три фермента и белок-субстрат. Ферменты находятся в форме предшественников, первый из них, Фактор С, способен специфически связываться с эндотоксинами. Он переходит в активную форму: активный Фактор С. Активный Фактор С переводит в активную форму следующий фермент: Фактор В. Последний в ряду ферментов, профермент, и его активная форма: свертывающий фермент. Свертывающий фермент перерабатывает субстрат: коагулоген. Молекула коагулогена разрезается на несколько полипептидных цепей, между которыми затем образуются связи, в результате чего получается пространственная структура геля.
Система коагуляции мечехвоста |
|
Ферменты, составляющие систему свертывания мечехвостов, являются сериновыми протеазами, очень похожими на факторы свертывания крови у млекопитающих. То же самое можно сказать и о субстрате, не случайно название коагулоген сходно с названием белка субстрата в системе коагуляции млекопитающих: фибриногеном.
Для активации ферментной системы, точнее первого фермента в каскаде, Фактора С, нужны минимальные концентрации бактериальных эндотоксинов.
В основе всех методов оценки концентрации эндотоксинов лежит измерение степени активации ферментной системы, хотя способы измерения её активности могут быть различными. Концентрация эндотоксина может быть определена путем оценки количества переработанного субстрата (естественного или искусственного) за определенный промежуток времени: анализы по конечной точке. Она также может быть определена путем оценки времени, необходимого для переработки определенного количества субстрата (точнее по определению скорости этой переработки): кинетические анализы.
|
|
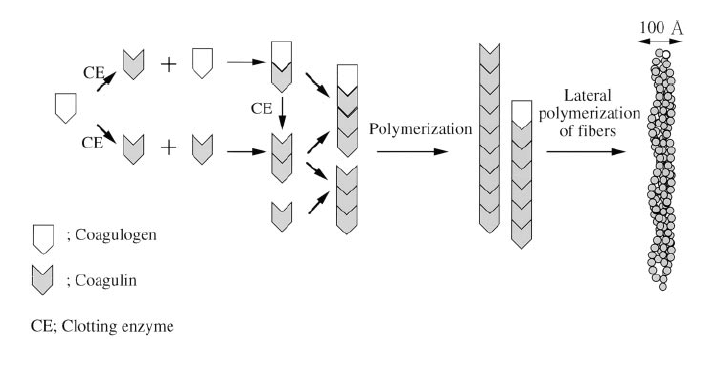
В естественной ситуации свертывающий фермент разрезает коагулоген на несколько фрагментов, которые затем полимеризуются. В результате реакции с прозрачной реакционной смесью происходят изменения, которые выражаются в помутнении содержимого, образовании вязких гелевых масс и, в конце концов, в образовании твердого геля. Гель, образующийся в результате реакции, удерживается в виде плотного опалесцентного сгустка на дне пробирки при ее переворачивании на 180°. Такой наиболее простой способ оценки активности ферментной системы называется гель-тромб тест.
Процессу образования геля предшествует процесс полимеризации субъединиц коагулина, который сопровождается помутнением реакционной смеси. Степень этого помутнения может быть измерена фотометрически. Чем выше концентрация эндотоксина, тем активнее ферментная система, тем меньше надо времени для переработки субстрата, тем быстрее идет реакция. Метод, в котором результат реакции определяется по степени этого помутнения, называется турбидиметрическим тестом.
Пожалуй, наиболее интересным способом измерения активности ферментной системы является хромогенный тест. Для проведения этого анализа используется специальный ЛАЛ-реактив, в котором коагулоген заменен на искусственный хромогенный субстрат. Хромогенный субстрат представляет собой простой полипептид с хромофором на конце. Последовательность аминокислотных остатков в полипептиде аналогична аминокислотной последовательности коагулогена, предшествующей связи, разрезаемой свертывающим ферментом. Активный свертывающий фермент отрезает хромофор от пептидной цепи, и в растворе развивается желтое окрашивание. Интенсивность окраски пропорциональна активности свертывающего фермента, которая в свою очередь определяется количеством эндотоксина в растворе. Интенсивность окраски также измеряется фотометрически.
Кинетические методы позволяют проводить точное количественное определение концентрации эндотоксина в растворе. Они позволяют во многом стандартизировать и автоматизировать процесс проведения реакции. Важным считается и тот факт, что автоматическая обработка и хранение результатов снижают риск получения ошибки, связанной с человеческим фактором.